La formation de ressource par les évaporites, la potasse
Dans le chapitre précédent nous avons vu comment se forme les hydrocarbures dans les régions pré-salifères. Ici nous allons voir comment se forme la potasse et plus particulièrement la potasse d'alsace.
Pourquoi la potasse ?
La potasse (KOH) est souvent utilisée comme agent chimique à forte activité basique, très utile pour déboucher les éviers par exemple. En fait quand on parle de potasse on parle de la potasse (KOH), mais aussi et surtout de tous les sels de potassiums, comme le chlorure de potassium (KCl). Les sels de potassiums ont un rôle extrêmement important dans nos économies modernes car ils sont à l'origine de la majorité des engrais chimiques. La population mondiale étant en constante augmentation les besoins nutritionnels de notre espèce sont aussi en augmentation rapide et l'utilisation d'engrais chimiques est chose courante dans l'agriculture moderne. Par conséquent il faut trouver régulièrement des nouvelles sources de potasse.
Où trouver la potasse ?
Ceux qui ont des caves humides, ont déjà pu observer des traces blanches solidifées le long des murs. Ces cristaux sont en fait des cristaux de salpètre, connus des chimistes sous le nom de nitrate de potassium (KNO3). Le salpètre provient donc d'un sel (ions K+ et NO3-) dissout dans le sol, qui a été transporté par l'humidité et c'est accumulé à un endroit après l'évaporation de l'eau. On peut donc déduire que le potassium est fortement présent dans le sol.
 Toutefois le salpètre n'est pas facile à exploiter car il faut drainer des sols et l'exploitation réduit la teneur du sol en potassium et donc l'épuisement de la ressource. Un autre moyen d'obtenir du potassium est de le rechercher dans les roches de type évaporites.
Toutefois le salpètre n'est pas facile à exploiter car il faut drainer des sols et l'exploitation réduit la teneur du sol en potassium et donc l'épuisement de la ressource. Un autre moyen d'obtenir du potassium est de le rechercher dans les roches de type évaporites.
La potasse dans les évaporites
Comme nous l'avons vu au chapitre précédent, les évaporites sont formées lors de l'évaporation d'eau (comme pour les marais salant) entraînant les dépots de sels. L'ion potassium étant relativement fréquent il doit être possible de trouver des roches fortement enrichie en potassium. Ces le cas de la Sylvinite, par exemple, qui est constituée de cristaux de KCl et présente une couleur rosée. Toutefois, la sylvinite étant une roche évaporite (ou salifère) on ne va pas la trouver totatlement pure, nous trouverons des filons de sylvinite au milieu de Halite (NaCl), d'anhydrite (NaSO4), de marnes, parfois au milieu de calcaire (CaCO3).
 Photographie d'une sylvinite (rose) dans laquelle on peut aussi voir des traces de halite (grise), d'anhydrite et de marnes (blanches)
Photographie d'une sylvinite (rose) dans laquelle on peut aussi voir des traces de halite (grise), d'anhydrite et de marnes (blanches)
La formation des évaporites
Pour comprendre la formation des évaporites, le plus simple est de comprendre le principe des marais salants, ou de faire l'expérience soit même. L'expérience est facile à réaliser à la maison ou en laboratoire. Il suffit de prendre de l'eau de mer de la laisser s'évaporer lentement. L'eau de mer contenant différents sels, ils vont précipiter progressivement lorsqu'ils arrivent à saturation (c'est à dire lorsque leur concentration est supérieure à la capacité de dissolution du liquide, la saturation est fonction de la température, plus la température est élevée, plus il y aura de sels dissout). Dès que les sels dépassent le point de saturation ils précipitent en formant des cristaux. Voilà ce qu'on obtient lorsqu'on laisse précipiter de l'eau de mer à température ambiante.
| Sels |
eau évaporée (%age du volume total) |
poids total (g de produit sec) |
| CaSO4 (gypse) | 74 | 1,4 |
| NaCl (halite) | 91 | 27,3 |
| KCl (sylvinite) | 98 | 0,7 |
| MgSO4 (magnésite) | 98 | 2,2 |
| MgCl2 (carnalite) | 98 | 3,3 |
Tableau récapitulatifs des cristaux de sels obtenus par précipitation d'un litre d'eau de mer à température ambiante.
Dans les marais salant les bassins sont peu profond, ce qui permet une élévation de la température, ce qui améliore la solubilité du CaSO4 et diminue celle du NaCl. Ainsi le sel précipite le premire et il est donc possible de récupérer la fleur de sels (les premiers cristaux de sels) sans récupérer les autres sels, pour celà l'eau est changée régulièrement pour ne pas arriver à saturation des autres sels.
La potasse est très peu présente dans l'eau de mer, il faut donc des conditions particulières pour que la sylvinite puisse se former lors de l'évaporation de l'eau de mer. Une simple évaporation rapide, ne permettra pas d'obtenir des quantités de suffisantes de KCl pour former de la sylvinite, dans le meilleur des cas, il y aurait des traces de sylvinite dans les halites.
La formation de la sylvinite
Le meilleur exemple de la formation de la sylvinite est l'alsace. La sylvinite c'est formée, il y a environ 40 million d'année dans le bassin Rhénan (vallée du Rhin). Comme pour le sel va se former dans des saumures. Une saumure est un marais ou une lagune avec une forte salinité qui est reliée plus ou moins régulièrement à un océan. Au début du jurassique le fossé rhénan est recouvert par l'océan alpin qui va progressivement se retirer. A partir de l'éocène le fossé rhénan n'est plus que partiellement relié à l'océan alpin, il y a donc formation de diverses lagunes. Ces lagunes vont former des évaporites, comme décrit ci-dessus, mais pourquoi de la sylvinite et pas de la halite? En fait un élément de réponse est observable dans le forage suivant :
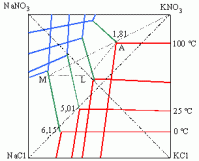
 On constate une alternance de couches de sylvinite et de sel gemme (halite). On peut donc déduire qu'il y a eu des modifications climatiques qui vont favoriser soit la précipitation du NaCl soit la précipitation du KCl. Nous avons vu précédemment que le NaCl précipite mieux lorsque la température est élevée (aux environs de 40°C), mais qu'en est-il pour le KCl? Les études au laboratoire ont permis de démontrer que les sels de potassium sont très solubles lorsque la température est élevée mais beaucoup moins lorsque la température est basse (plus on est proche de 0°C, plus la concentration de saturation est facile à attenindre pour le KCl, voir schéma).
On constate une alternance de couches de sylvinite et de sel gemme (halite). On peut donc déduire qu'il y a eu des modifications climatiques qui vont favoriser soit la précipitation du NaCl soit la précipitation du KCl. Nous avons vu précédemment que le NaCl précipite mieux lorsque la température est élevée (aux environs de 40°C), mais qu'en est-il pour le KCl? Les études au laboratoire ont permis de démontrer que les sels de potassium sont très solubles lorsque la température est élevée mais beaucoup moins lorsque la température est basse (plus on est proche de 0°C, plus la concentration de saturation est facile à attenindre pour le KCl, voir schéma).
Graphique représentant la solubilité de différents ions en fonction de la température, on constate que le NaCl précipite mieux à haute température alors que le KCl précipite mieux à basse température.
L'alternance des couches de halites et de sylvinite peut donc s'expliquer par des variations de saisons dans une saumure. Au printemps, lors de la fonte des neiges, la saumure est alimentée en eau. A la fin du printemps, début de l'été de l'eau de mer va entrer dans la saumure. Puis l'évaporation va agir. La concentration en sel va augmenter progressivement et une partie du NaCl va précipiter. Lors de l'automne et de l'hiver la concentration en KCl est élevée, l'évaporation se poursuit lentement, la température diminue ce qui favorise la précipitation du KCl au profit du NaCl. Ainsi d'année en année, et fonction des conditions climatiques le KCl va précipiter plus que le NaCl dans la saumure et former de la sylvinite.
Un site complémentaire sur la potasse d'alsace.
chapitre précédent :
retour :
chapitre suivant :
Date de dernière mise à jour : 05/07/2021